O que é Stewardship de antimicrobianos?
Stewardship vem do inglês e significa cuidar e administrar recursos de forma responsável, visando preservar seu valor a longo prazo, seja no contexto ambiental, financeiro ou social.
Quando abordamos Stewardship de antimicrobianos, estamos abordando a gestão de antimicrobianos ou programas de gerenciamento de antibacterianos, antifúngicos, antivirais e antiparasitários.
Esses programas envolvem:
- Melhorar e mensurar o uso de antimicrobianos;
- Seleção mais apropriada dos antimicrobianos, dosagem, duração da terapia e via de administração;
- Fornecer um padrão de uso de antimicrobianos no hospital por meio do perfil epidemiológico.
Como a farmacocinética (PK) e a farmacodinâmica (PD) podem contribuir no Stewardship dos antimicrobianos?
A farmacocinética refere-se ao estudo do movimento de um fármaco no corpo, abrangendo aspectos como sua absorção, distribuição, metabolismo e eliminação (ADME). Aspectos importantes da farmacocinética incluem a taxa de absorção do fármaco após a administração, a concentração sanguínea ao longo do tempo, o processo de metabolização pelo corpo e sua excreção.
Já a farmacodinâmica se concentra nos efeitos do fármaco no corpo e como esses efeitos se relacionam com a concentração do medicamento no local de ação, explorando como um fármaco afeta os sistemas biológicos, quais receptores ou alvos ele interage, qual é a magnitude da resposta biológica e como essa resposta se relaciona com a sua concentração.
Como a farmacocinética (PK) pode ajudar?
Alguns conceitos dentro da farmacocinética são essenciais para entender como os modelos PK/PD funcionam. Por exemplo, a concentração máxima plasmática (Cmax) é a concentração máxima alcançada do fármaco para uma determinada dose terapêutica. A área sob a curva (AUC) é um parâmetro farmacocinético fundamental que descreve a exposição total de um medicamento ao longo do tempo no corpo de um paciente. Em outras palavras, a AUC representa a quantidade total de fármaco que atinge a corrente sanguínea ou um local específico no organismo durante um determinado período após a administração de uma dose.
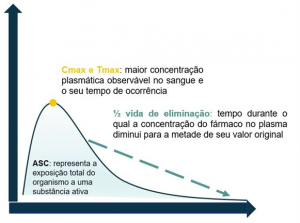
Figura 1. Exemplificação dos parâmetros farmacocinéticos.
Esses parâmetros farmacocinéticos podem ser moldados pelas condições clínicas dos pacientes, por exemplo: pacientes que apresentam insuficiência renal possuem clearance renal reduzido que, consequentemente, influenciará na eliminação do antimicrobiano, o que irá aumentar a concentração plasmática do mesmo e risco de toxicidade ao paciente.
Por outro lado, considere também a condição fisiológica do paciente, por exemplo, um edema pulmonar que requer o uso concomitante de algum diurético pode aumentar o clearance renal do antimicrobiano, potencialmente diminuindo sua meia-vida plasmática. Isso pode ter implicações significativas na eficácia do tratamento e requer uma avaliação cuidadosa.
Os efeitos antimicrobianos podem ser dificultados por diversos fatores fisiológicos do paciente, tais como:
- O nível de hidratação do paciente pode influenciar a absorção de certos antimicrobianos.
- A interação entre os antimicrobianos e alimentos, possivelmente diminuindo ou retardando a biodisponibilidade do fármaco.
- Baixo nível de proteínas plasmáticas e a desnutrição do paciente podem afetar a distribuição plasmática desses medicamentos e consequentemente sua eficácia terapêutica.
- O metabolismo intestinal e hepático dos antimicrobianos, podendo levá-los à inativação ou redução de sua meia-vida plasmática.
Após compreender alguns dos parâmetros clínicos do paciente, é viável otimizar a dose dos antimicrobianos.
E a farmacodinâmica, como pode racionalizar o uso dos antibacterianos?
A farmacodinâmica demonstra a capacidade bacteriostática e bactericida que os antibacterianos possuem em relação aos patógenos que afetam nosso organismo. Ambas as medidas podem ser adquiridas facilmente por meio de estudos in-vitro.
A concentração inibitória mínima (MIC – do inglês “Minimum Inhibitory Concentration”) é a menor concentração (mg/L ou mg/mL) da droga capaz de inibir o crescimento bacteriano, por exemplo. A MIC não determina o grau de lise ou morte das bactérias, mas sim o quanto um antibacteriano pode inibir o crescimento bacteriano. Quando necessitamos avaliar o poder bactericida ou capacidade de matar as bactérias, nós podemos calcular a Concentração Bactericida Mínima (MBC – do inglês “Minimal Bactericidal Concentration”). Em geral, quanto menor o MIC e MBC, mais potente é o antibacteriano.
Porém, esses parâmetros farmacodinâmicos levam em consideração só a interação isolada com o microrganismo, não correlacionado com organismo e os fatores fisiológicos e clínicos que podem interferir na concentração do fármaco que alcança o sítio de infecção.
Sobre os modelos PK/PD:
De maneira geral, os fármacos quando administrados irão alcançar a corrente sanguínea, seguindo para seu sítio de ação e irão promover um efeito farmacológico.
Se tratando dos antimicrobianos, esses fármacos têm a finalidade de erradicar os patógenos presentes em nosso corpo. Assim, é preciso garantir que a dose administrada seja adequada para que a concentração do antimicrobiano seja suficiente para alcançar seu sítio de ação, nesse caso o local da infecção onde encontra-se o microrganismo patogênico.
Resumindo, os antimicrobianos precisam ter:
- Concentração suficiente para alcançar o local da infecção.
- Penetração no sítio da infecção para erradicar o patógeno.
Dessa forma, os modelos PK/PD combinam esses dois aspectos: concentração do fármaco em função do tempo e efeito farmacológico, para fornecer uma compreensão completa de como um antimicrobiano interage com o microrganismo. Esses modelos podem ser usados para otimizar o desenvolvimento de novos fármacos, determinar dosagens apropriadas e individualizadas, prever a eficácia e a segurança dos medicamentos e entender as variações na resposta entre pacientes.
Então quando temos os parâmetros farmacocinéticos em associação com a concentração inibitória mínima podemos criar os modelos PK/PD. Ou seja, integrar os dados clínicos do paciente em associação com a farmacocinética do antimicrobiano e os dados de morte microbiana.
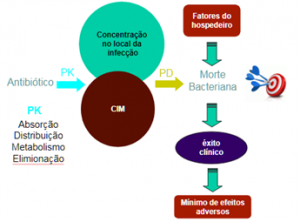
Figura 2. Considerações para o efeito farmacológico dos antibacterianos. Fonte: Elaborada pelo autor
Assim, é possível estabelecer relações lineares entre as concentrações plasmáticas dos antimicrobianos e os valores obtidos do CIM, sugerindo certas inferências, por exemplo: as concentrações dos antimicrobianos abaixo do CIM não irão obter resultados efetivos, como erradicação microbiana.
Indices PK/PD
Os índices PK/PD são os parâmetros que visam demonstrar a relação entre a concentração do antibacteriano e o efeito farmacológico observado (morte ou inibição do crescimento bacteriano). Alguns índices podem ser descritos da seguinte forma: 1) T>MIC 2) Cmax/MIC 3) AUC/MIC.
Primeiro, o T>MIC estabelece que a eficácia máxima se dar quando o microrganismo fica exposto por tempo (T) prolongado com uma concentração em torno de quatro vezes acima da MIC. Esse tipo de índice é favorável para os antibacterianos beta-lactâmicos, macrolídeos e clindamicina. Para outros antibacterianos, como os aminoglicosídeos e fluoroquinolonas, a sua ação bactericida é dependente da concentração do fármaco, ou seja, suas ações bactericidas são principalmente observadas em altas concentrações, como pode ser mensurado pelo índice Cmax/MIC. Para antibacterianos como a vancomicina, o índice mais empregado é AUC/MIC que necessitam também de elevadas concentrações do antibacteriano, mas com uma característica que é de ser tempo-dependente.
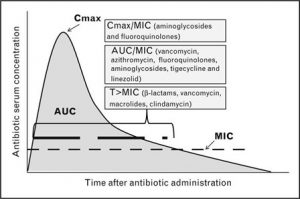
Figura 3. Índices PK/PD. Fonte: Al-Dorzi HM, Al Harbi SA, Arabi YM. Antibiotic therapy of pneumonia in the obese patient: dosing and delivery. Curr Opin Infect Dis. 2014 Apr;27(2):165-73.
Como pode ser visto nesta tabela, o alvo clínico da PK-PD muda dependendo do tipo de antibiótico:
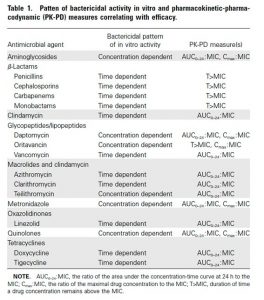
Fonte: Ambrose PG, Bhavnani SM, Rubino CM, Louie A, Gumbo T, Forrest A, Drusano GL. Pharmacokinetics-pharmacodynamics of antimicrobial therapy: it’s not just for mice anymore. Clin Infect Dis. 2007.
Elaborado por: Gessualdo Junior (Farmacêutico)
Revisado por: João Victor Laureano (Professor e Farmacêutico Clínico e Hospitalar)
Referências:
Ambrose PG, Bhavnani SM, Rubino CM, Louie A, Gumbo T, Forrest A, Drusano GL. Pharmacokinetics-pharmacodynamics of antimicrobial therapy: it’s not just for mice anymore. Clin Infect Dis. 2007.
FEDERICO, Marilia Pinto et al. Noções sobre parâmetros farmacocinéticos/farmacodinâmicos e sua utilização na prática médica. Revista da Sociedade Brasileira de Clínica Médica, v. 15, n. 3, p. 201-205, 2017.
Valero, A.; Rodríguez-Gascón, A.; Isla, A.; Barrasa, H.; del Barrio-Tofiño, E.; Oliver, A.; Canut, A.; Solinís, M.Á. Pseudomonas aeruginosa Susceptibility in Spain: Antimicrobial Activity and Resistance Suppression Evaluation by PK/PD Analysis. Pharmaceutics 2021.
ZHANG, Longfei et al. Pharmacodynamic parameters of pharmacokinetic/pharmacodynamic (PK/PD) integration models. Frontiers in Veterinary Science, v. 9, p. 860472, 2022.
PEREIRA, Laiz Campos et al. Pharmacokinetic/pharmacodynamic modeling and application in antibacterial and antifungal pharmacotherapy: a narrative review. Antibiotics, v. 11, n. 8, p. 986, 2022.





